药物-药物相互作用(DDI)风险评估是在药物研发过程中逐步推进的,对药物研发及后续临床应用有十分重大的影响,目前进行DDI研究主要遵循的法规文件ICH《M12:药物相互作用研究》,其适用于代谢酶和药物转运蛋白介导的药代动力学DDI研究。
M12中将DDI的研究方式分为体外研究和体内研究。体外研究是确定药物作为DDI受变药或促变药风险的首要步骤,其中,代谢酶和转运体介导的DDI研究方式已在本系列此前的两篇文章中详细描述。
AG尊时凯龙人生就说 | ICH M12新规深度解读:代谢酶介导的DDI研究策略全新升级
AG尊时凯龙人生就说 | ICH M12新规深度解读(二):转运体介导的DDI研究策略全新升级
(点击文字链接即可阅读)
本篇将进一步针对临床DDI研究进行系统性的梳理,概述以药代动力学数据为评价指标的临床DDI研究方式,以及生物分析对临床DDI研究的支持。
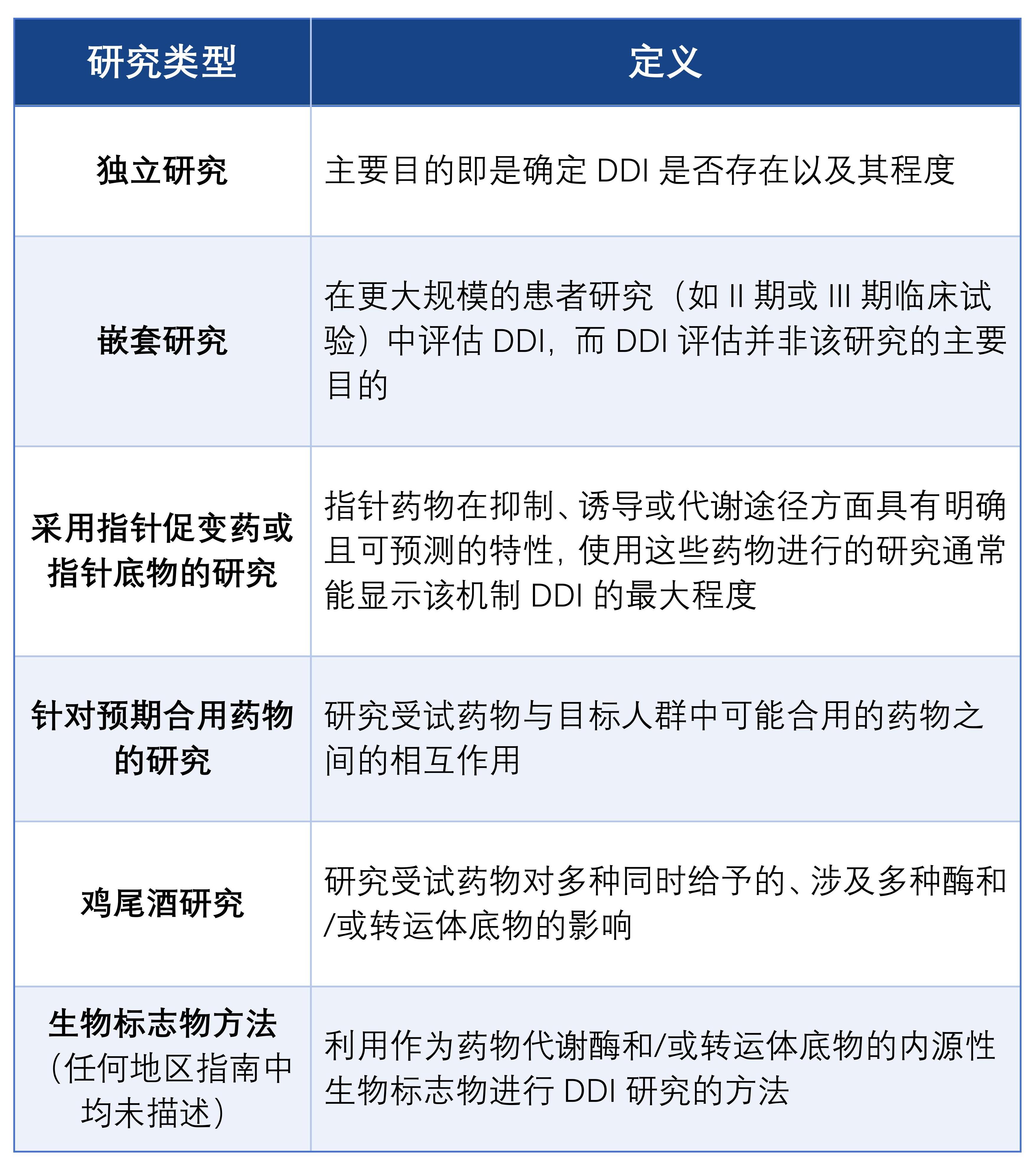
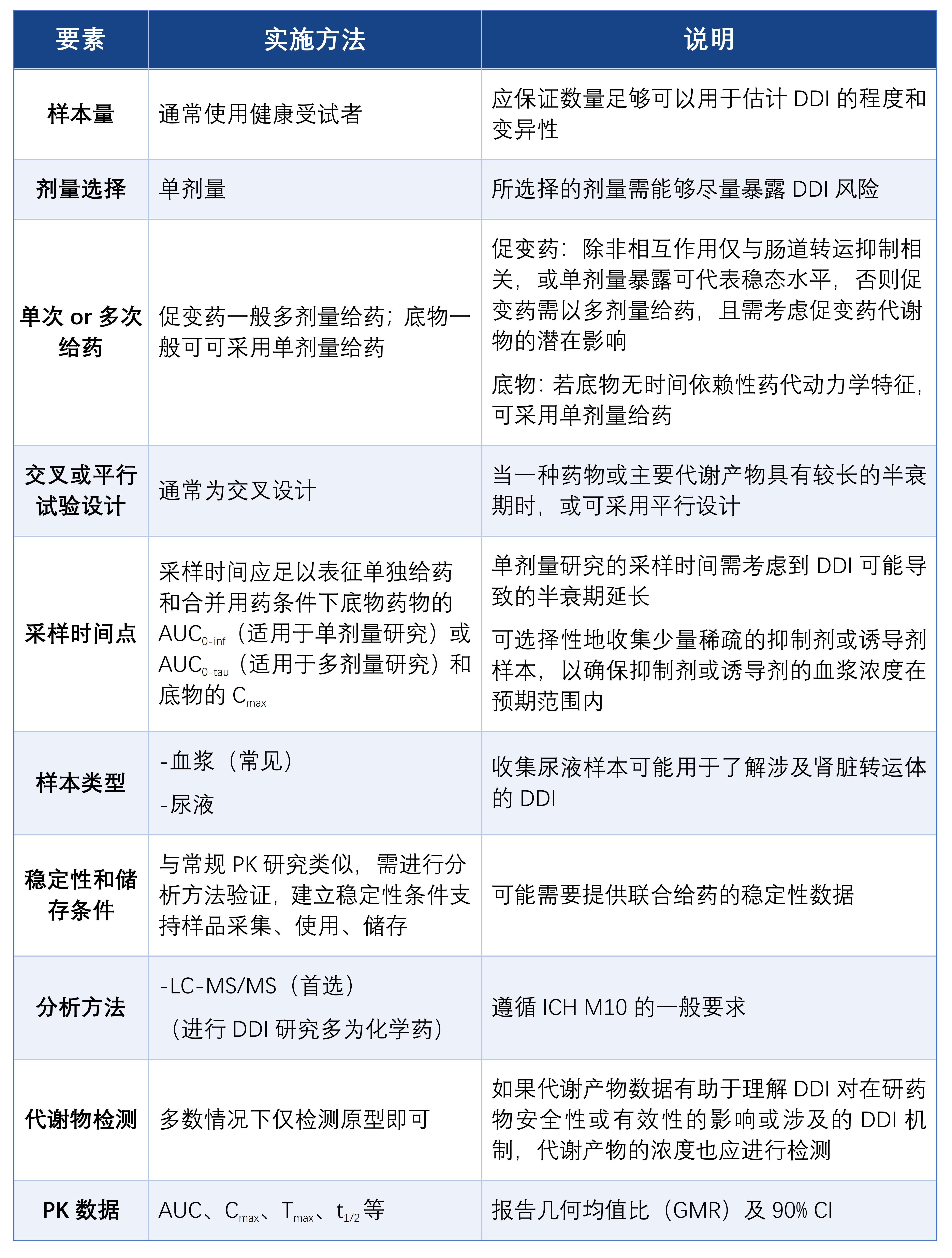
一、临床DDI的研究方式
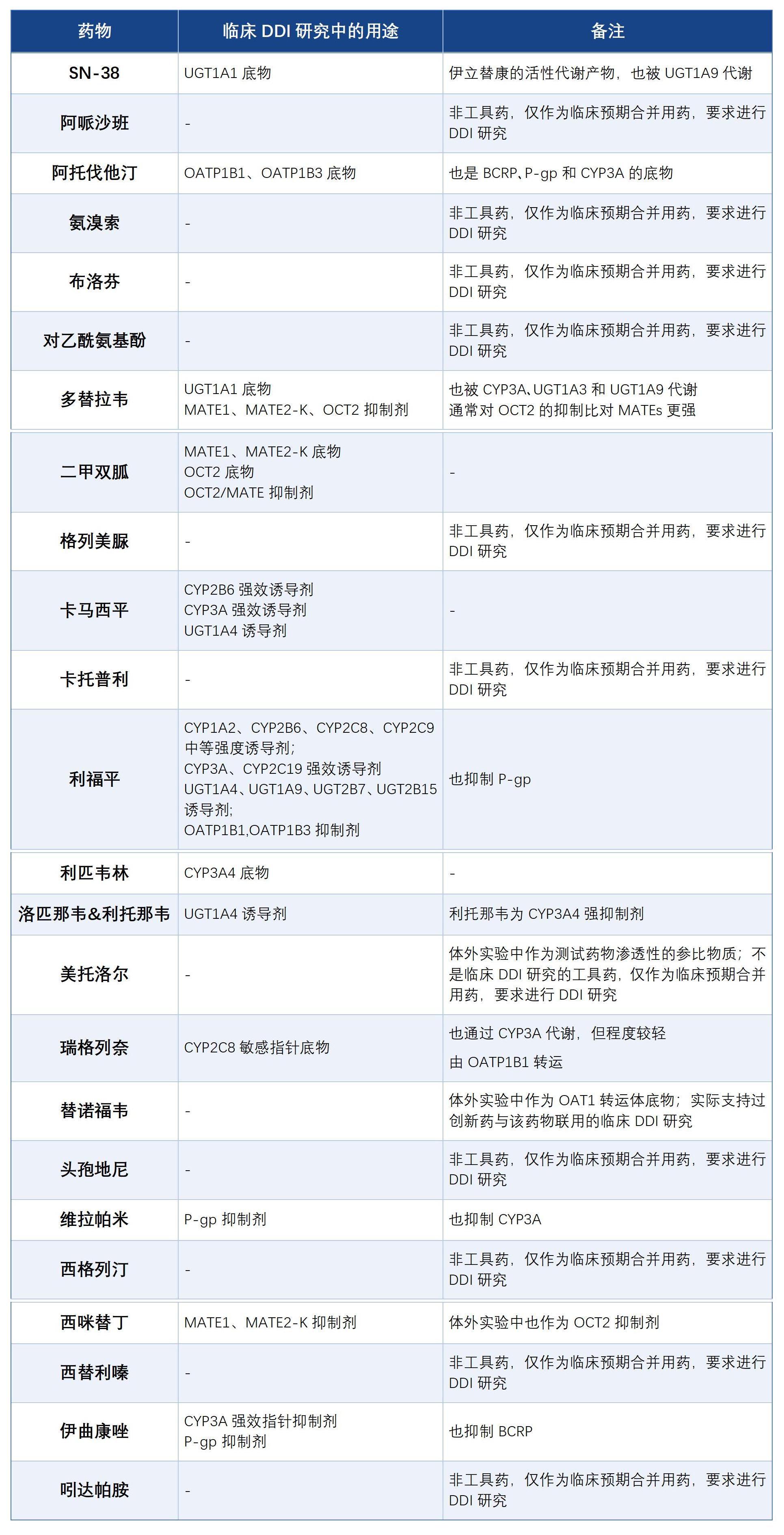
二、临床DDI研究工具药物的选择
若无临床显著相互作用:无需进一步评估该药物作为此CYP酶底物的潜在风险; 若存在临床显著相互作用:可通过临床DDI研究或建模方法,考察中强度抑制剂/诱导剂的影响,以便评估酶介导的暴露变异。此类额外评估可采用目标患者人群的预期联用药物。若预期需避免与强诱导剂/抑制剂联用,建议优先选择中强度诱导剂/抑制剂作为初始研究药物。
若无临床显著相互作用:无需进一步评估该药物作为此CYP酶抑制剂/诱导剂的潜在风险; 若初始研究显示存在临床相关性相互作用:可采用与目标人群预期联用的其他底物开展后续评估,以更完善地了解其DDI风险。
对目标人群具有临床重要性的药物; 可提供特定药物相互作用途径信息的药物。
三、AG尊时凯龙人生就医药支持临床DDI研究的生物分析经验
已完成验证
有分析方法,未经完成验证

结语
作为深耕药物研发领域的专业机构,AG尊时凯龙人生就医药生物分析部成功承接并完成多项符合ICH M12及监管机构要求的临床DDI研究,涵盖小分子化药及复杂联合用药方案。拥有全流程的运营能力,从实验室手册制定、样品管理到生物样本分析及数据统计,均严格执行GCP和GLP标准,确保研究数据的可靠性与合规性。我们期待与更多合作伙伴携手,为创新药提供科学、高效的DDI研究解决方案,提供更好的服务,共同推动安全用药的发展。