眼是我们通向世界的窗户,随着世界人口老龄化程度的提高、生活方式的改变,白内障、青光眼、年龄相关性黄斑变性(AMD)、糖尿病视网膜病变(DR)、糖尿病性黄斑水肿(DME)、视网膜静脉阻塞(RVO)、干眼病及过敏性结膜炎等眼科疾病,发病率逐年上升,在当前全球人口老龄化不断加剧的背景下,这些“定时炸弹”不仅影响个人的身体健康和生活质量,还给家庭和社会带来了严重的经济负担,已成为重大公共卫生问题和社会问题。
随着科学技术的不断发展以及人们对眼科疾病发病机制认识的不断深入,眼科治疗药物研发取得了突破性的进展。全球药物市场分析数据显示,眼科药物市场增长约是医药行业整体增长速度的2.5 倍[1]。越来越多的新创企业和生物公司加入到眼科药物研发行列,眼科药物开发正面临前所未有的机遇。眼科药动学是药动学的一个分支,研究眼部各组织对药物吸收、分布、代谢和排泄的时间过程,并可用数学模型进行定量表示,相对整体药动学更精细、复杂。
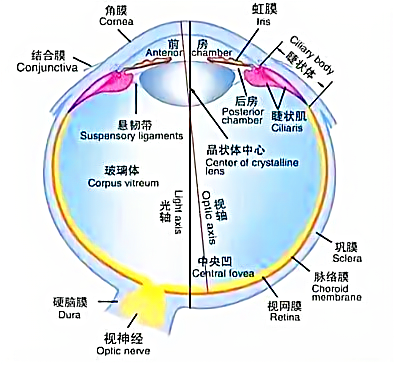
一、眼的解剖结构
二、眼科药物常见给药途径
1 ? 局部给药 2 ? 玻璃体腔注射 3 ? 眼周给药
结膜下给药:结膜是一种薄而半透明的黏液分泌组织,与角膜相连,覆盖在巩膜上方,在结膜和巩膜之间的空隙即为结膜下。结膜下给药一次可给予大约500 μL。 筋膜下给药:可将药物直接注射于筋膜囊和巩膜之间的间隙中,一次最大可注射4 mL,常用于眼科手术时的麻醉剂给药,常见的不良反应包括结膜下出血、结膜肿胀及眼部疼痛。 球周给药:在上下直肌和内外直肌外侧给药,根据注射部位又分为前或后球周注射,一般用于白内障手术时的麻醉药物给药,一次可注射8 ~10 mL。 球后给药:一种直接穿过眼睑和眶筋膜将药物注射入上下直肌和内外直肌的肌间隙,主要用于麻醉药物,这种给药方式有损伤视神经的风险。
不同给药途径的优缺点见下表1[5-8]。
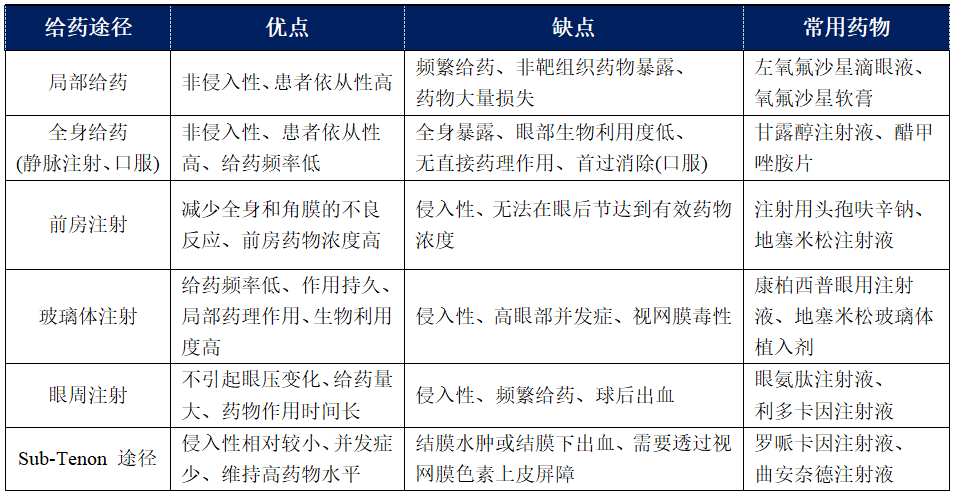
【表1】不同眼部给药途径的优缺点
三、动物种属的选择依据
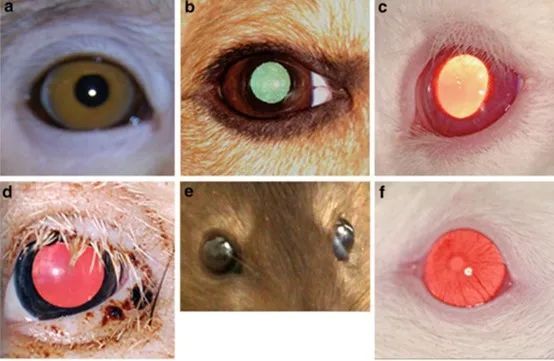
【图1】眼睑结构和眼球暴露:a 食蟹猴 b 犬 c 新西兰大白兔 d 哥廷根小型猪 e Brown Norway大鼠 f 白化小鼠
由于眨眼可影响局部给药的供试品在眼内的停留时间以及泪膜,因此眨眼频率可提供不同种属给药后局部或全身反应的一些解释角度。与较慢的眨眼速率相比,更快的眨眼速率可缩短药物在眼部的停留时间,并改变局部给药供试品的全身吸收特征。不同种属的眨眼频率见表2。
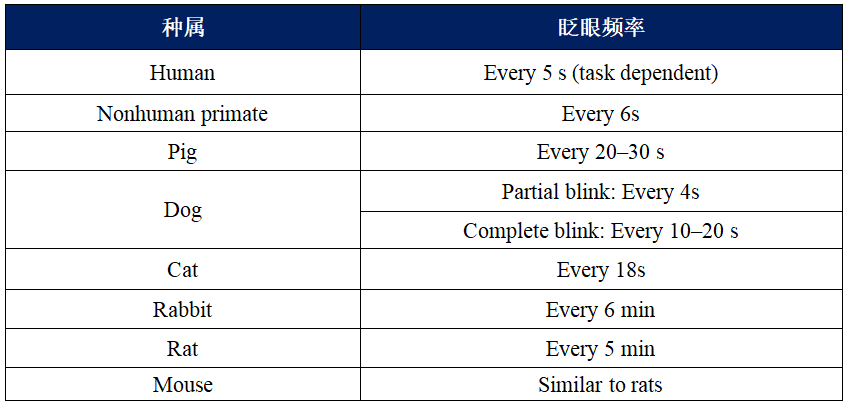
【表2】不同种属的平均眨眼频率[9]
四、眼组织生物样品的采集和处理
按照结构组成和样品后续处理程序的不同分为:
① 泪液,主要由蛋白、脂质、碳水化合物和电解质组成,可采用泪液检测滤纸条采集;
② 房水,和血浆超滤液电解质浓度基本相似,但房水中蛋白含量很低,约是血浆蛋白浓度的0.5%,样品处理方法相对简单;
③ 玻璃体液,主要由水组成,但含有胶原蛋白、透明质酸及其他蛋白聚糖,这使玻璃体液具有凝胶样性质,药物在玻璃体液中不均匀分布,因此应将全部玻璃体液混匀后再取样分析;
④ 角膜、巩膜和晶状体组织含有胶原蛋白、糖胺聚糖和蛋白聚糖,难以匀浆,需要更长或更多的匀浆处理操作;
⑤ 虹膜、睫状体、脉络膜和视网膜组织中存在黑色素,若药物与黑色素结合,可能会影响药物的检出,样品处理和分析时应考虑黑色素结合对检测结果的影响。
动物安乐死后,眼组织中的生物屏障会迅速破坏,药物会在整个眼组织中迅速达到平衡。眼组织中的酯酶在离体条件下也有一定的活性。因此处理动物后,应迅速摘取眼球并立即放入液氮或干冰中保存,以防止药物转移到邻近组织中或被代谢消除,解剖分离眼组织时也应全程在冷冻状态下完成[10-11]。
结语
眼具有的特殊的解剖生理结构和屏障系统,使外源药物很难进入眼内。不同给药途径下,药物在眼内的药代动力学特征和风险也各不相同。 因此,眼科新药非临床研究也不同于其他药物,药效、药代动力学方面需证明药物可在靶组织中达到有效治疗浓度,安全性方面需同时考察全身毒性和眼局部毒性。对于眼科新药,应根据拟定适应证、用药人群、给药途径、给药期限、给药频率,按照“Case-by-Case”及“基于风险”的原则分阶段的开展相应的非临床研究,为拟开展的临床试验或上市提供支持性数据。
参考文献:
[1]Gower NJ,Barry RJ,Edmunds MR,et al.Drug discovery in ophthalmology:past success,present challenges,and future opportunities [JJ.BMC Ophthalmol,2016,161):1-11.
[2] Barar J,Aghanejad A,Fathi M,et al.Advanced drug delivery and targeting technologies for the ocular diseases [J] Biolmpacts,2016,6(1):49-67.
[3] Agrahari V,Mandal A,Agrahari V,et al.A comprehensive insight on ocular pharmacokinetics [J].Drug Deliv Transl Res,2016,6(6):735-754.
[4] Cholkar K,Vadlapudi AD,Trinh HM,et al.Compositions,Formulation,pharmacology,pharmacokinetics, and toxicity of topical,periocular,and intravitreal ophthalmic drugs [M].Gilger,Brian C.Ocular pharmacologyand toxicology.New York:Humana Press.2014:91-118.
[5] Carvalho Im,Marques CS,Oliveira RS,et al.Sustained drug release by contact lenses for Glaucomatreatment-Areview [J].J Control Release,2015,202:76-82.
[6] Nayak K,Misra M.A review on recent drug delivery systemsfor posterior segment of eye [J].Biomed Pharmacother,2018,107:1564-1582.
[7] Johnson KS,Chu DS.Evaluation of sub-Tenon triameinoloneacetonide injections in the treatment of seleritis [J].Am J Oph-thalmol,2010,149(1):77-81.
[8] Mandal A,Bisht R,Rupenthal I,et al.Polymeric mi-celles for ocular drug delivery:From structural frameworks to re-cent preclinical studies J Control Release,2017,248:96-116.
[9] Weir A B, Collins M.[Molecular and Integrative Toxicology] Assessing Ocular Toxicology in Laboratory Animals || Comparative Ocular Anatomy in Commonly Used Laboratory Animals[J]. 2013, 10.1007/978-1-62703-164-6(Chapter 1):1-21.DOI:10.1007/978-1-62703-164-6_1.
[10] 武峰,赵秀丽,滴眼剂人眼部药代动力学研究的方法学探讨[J].中国临床药理学杂志,2015,31(5):395-397.
[11] 戴学栋,眼科药物非临床研究的考虑[J]. 中南药学杂志,l672-2981(2018)10-1345-04.